•Pengertian Larutan Garam ~ Epicologi
Pada kesempatan yang indah ini kami mencoba mengetengahkan tema yang cukup banyak dicari, yaitu mengenai Pengertian Larutan Garam. Kami sudah merangkum dari beberapa sumber serta dari pengalaman kami dalam penerapannya. Tak lupa kami menggunakan bahasa dan kosakata yang sederhana sehingga akan sangat mudah bagi siapapun yang membacanya. Nah, langsung disimak saja ulasannya dibawah ini.
Penjelasan Lengkap Pengertian Larutan Garam
Pengertian Larutan Garam, Sifat, Ciri, Jenis dan Contohnya : Adalah larutan yang didapat dari hasil reaksi asam dan basa. Garam merupakan suatu senyawa yang terbentuk jika hidrogen

Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Basa
Pengertian Garam
Garam merupakan salah satu kebutuhan yang merupakan pelengkap dari kebutuhan pangan dan merupakan sumber elektrolit bagi tubuh manusia. Garam umumnya merupakan hasil reaksi antara senyawa asam dan basa. Bentuk padatnya biasanya berupa kristal sedangkan dalam bentuk larutan unsur-unsur penyusun garam akan mengion kembali dan membuat larutan ini dapat menghantarkan listrik. Garam- garam yang tersusun dari logam alkali dan alkali tanah akan menghantarkan listrik lebih kuat. Garam yang paling umum dan banyak digunakan di masyarakat ialah garam NaCl, berupa padatan kristal berwarna putih.
Dalam ilmu kimia, garam ialah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga akan membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil sebuah reaksi asam dan basa. Hidrolisis garam adalah “terurainya garam dalam air yang menghasilkan asam dan atau basa.”
Bagaimanakah Hidrolisis dapat terjadi?
Hidrolisis garam hanya terjadi JIKA salah satu atau kedua komponen penyusun garam tersebut berupa asam lemah dan atau basa lemah. Jika komponen garam tersebut berupa asam kuat dan basa kuat, maka komponen ion dari asam kuat atau pun basa kuat tersebut Tidak akan terhidrolisis. Berdasarkan penjelasan tadi, maka kation dan anion yang dapat mengalami reaksi hidrolisis adalah kation dan anion garam yang termasuk elektrolit lemah. Sedangkan kation dan anion garam yang termasuk elektrolit kuat tidak terhidrolisis.
Reaksi garam dengan air, dimana komponen garam (kation atau anion) yang berasal dari asam lemah atau basa lemah bereaksi dengan air membentuk ion H3O+(=H+) atau ion OH–.
Jika hidrolisis menghasilkan H3O+ maka larutan bersifat asam, tetapi jika hidrolisis menghasilkan ion OH– maka larutan bersifat basa.
Defini Larutan Garam
Larutan garam merupakan larutan yang didapat dari hasil reaksi asam dan basa. Garam merupakan suatu senyawa yang terbentuk jika hidrogen dari suatu asam diganti oleh suatu logam. Garam dinamakan menurut logam dan asam yang membentuknya. jika larut, garam membentuk ion di dalam larutan, satu kation dari logam dan satu anion dari asam (Kamus sains bergambar;2000).
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Buffer / Penyangga
Sifat Larutan Garam
Sifat Larutan Garam ada 3 Macam
- Larutan garam yang bersifat netral yaitu garam yang terbentuk dari asam kuat dan basa kuat atau terbentuk dari asam lemah dan basa lemah. Contoh : NaCl , CH3COONH4
- Larutan garam yang bersifat asam yaitu garam yang terbentuk dari asam kuat dan basa lemah. Contoh : NH4Cl, Al2(SO4)3
- Larutan garam yang bersifat basa yaitu garam yang terbentuk dari basa kuat dan asam lemah. Contoh : CH3COONa, Na2CO3
Larutan garam yang terbentuk dari asam lemah dan basa lemah dapat bersifat asam, basa, netral .Karena garam ini terhidrolisis sempurna, maka harga pH bukan tergantung pada konsentrasi garamnya, tetapi bergantung pada harga Ka dan Kb-nya.
- Jika Ka = Kb ,larutan garam bersifat netral (pH=7)
- Jika Ka = Kb , larutan garam bersifat asam (pH<7)
- Jika Ka = Kb , larutan garam bersifat basa (pH>7)
Sifat-sifat garam, yaitu sebagai berikut :
- Mampu menghantarkan arus listrik,
- tidak mengubah warna lakmus merah maupun biru.
- Jika terbentuk dari asam kuat dan basa lemah, maka garam akan bersifat asam. dan sebaliknya, jika terbentuk dari asam lemah dan basa kuat, maka garam akan bersifat basa.
- Bila terbentuk dari asam kuat dan basa kuat, maka garam akan bersifat netral, misalnya garam dapur (NaCl).
- Memiliki pH 7
Klasifikasi Garam Berdasarkan Sifatnya
Berdasarkan sifatnya setelah reaksi netralisasi asam-basa, garam terbagi menjadi menjadi :
- Garam Asam
Garam asam adalah garam yang terbentuk jika hanya sebagian hidrogen dari asam penyusun garam tergantikan oleh logam atau kation lain, jadi masih terdapat sisa sifat asam pada produk garam tersebut. - Garam Basa
Garam basa adalah garam yang terbentuk jika tidak semua gugus OH dari basa penyusun garam tersebut ternetralkan oleh suatu radikal asam (sifat basa/anion penyusun garam lebih kuat daripada sifat kation/asam penyusunnya). - Garam Netral
Garam netral adalah garam yang terbentuk dari reaksi netralisasi antara asam dan basa secara sempurna. Biasanya garam ini merupakan hasil reaksi asam kuat dengan basa kuat.
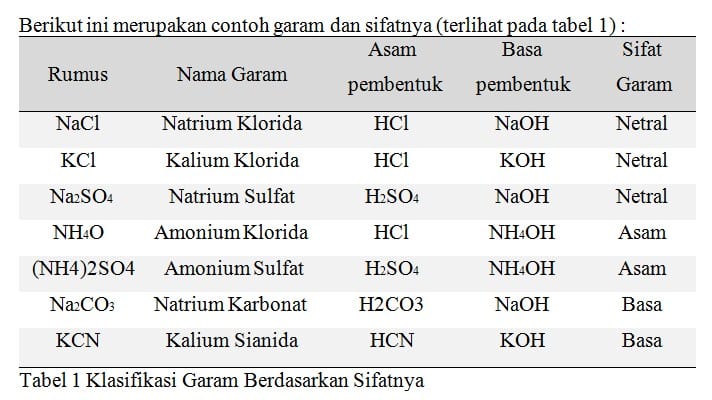
Klasifikasi Garam Berdasarkan Kelarutannya
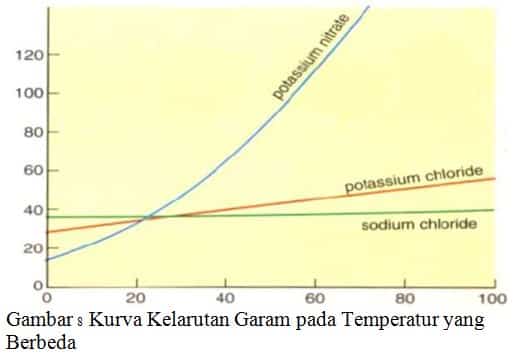
Garam klorida dan iodida dari golongan alkali dan alkali tanah umumnya mudah larut dalam air sedangkan garam klorida dan iodida dari logam-logam timbal dan perak tidak larut dalam air. Garam-garam nitrat umumnya larut dalam air, garam-garam karbonat sukar larut dalam air. Kelarutan garam natrium klorida, kalium klorida dan kalium nitrat pada temperatur yang berbeda dapat dilihat pada kurva berikut.
Berikut ini merupakan beberapa contoh garam yang mudah larut dan sukar larut

Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Asam – Pengertian, Ciri, Sifat, Hujan, Contohnya
Landasan Teori
- Larutan
Larutan didefinisikan sebagai campuran homogen antara dua atau lebih zat yang terdispersi baik sebagai molekul, atom maupun ion yang komposisinya dapat berpariasi. Larutan dapat berupa gas, cairan, atau padatan. Larutan encer adalah larutan yang mengandung sebagian kecil solute, relative terhadap jumlah pelarut. Sedangkan larutan pekat adalah larutan yang mengandung sebagian besar solute. Solute adalah zat terlarut. Sedangkan solvent (pelarut) adalah medium dalam mana solute terlarut (Baroroh, 2004). - Molaritas
Kemolaran atau Molaritas adalah banyaknya jumlah mol zat terlarut dalam tiap liter larutan. Atau konsentrasi suatu larutan yang mengukur banyaknya mol zat terlarut dalam tiap liter larutan. Kemolaran atau Molaritas dilambangkan dengan huruf M. Molaritas dapat dirumuskan sebagai berikut :
M=
Keterangan : M= kemolaran (mol/L)
n= mol zat (mol)
V= volume yang ditempati zat (L)
Pengenceran suatu larutan adalah suatu penambahan zat pelarut ke dalam suatu larutan sehingga konsentrasi larutan menjadi lebih kecil dengan menambahkan air (pelarut). Persamaan rumusnya adalah sebagai berikut :
M1.V1 = M2. V2
- Endapan
Endapan adalah zat yang memisahkan diri sebagai suatu fase padat keluar dari larutan. Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat yang bersangkutan. Kelarutan (S) suatu endapan menurut definisi adalah sama dengan konsentrasi molar dari larutan jenuhnya. Kelarutan bergantung pada berbagai kondisi seperti suhu, tekanan, konsentrasi bahan-bahan lain dalam larutan itu, dan pada komposisi pelarutnya (Lesdantina, 2009). - Konsentrasi Larutan
Konsentrasi larutan menyatakan secara kuantitatif komposisi zat terlarut dan pelarut di dalam larutan. Konsentrasi pada umumnya dinyatakan dalam perbandingan jumlah zat terlarut dengan jumlah pelarut. Contoh beberapa satuan konsentrasi adalah molar, molal, dan bagian per juta (part per million).
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap
Ciri Larutan Garam
Apabila larutan asam dengan larutan basa direaksikan, maka ion H+ (dari asam) akan bereaksi dengan ion OH– (dari basa) membentuk air. Reaksi antara asam dan basa ini disebut reaksi penetralan (netralisasi) jika jumlah zat asam sama dengan jumlah zat basa. Disebut demikian karena selain air, dihasilkan pula suatu zat yang bersifat netral yaitu garam, jika jumlah asam dan jumlah basanya mempunyai perbandingan yang sama. Reaksi ini juga di kenal dengan reaksi penggaraman karena menghasilkan garam.
Garam terdapat dalam bentuk garam netral, garam basa dan garam asam. Umumnya garam mudah larut dalam air, merupakan padatan pada suhu kamar (25oC), merupakan elektrolit sehingga dapat menghantarkan arus listrik, memiliki titik didih dan titik leleh yang tinggi.
Ciri-ciri garam yaitu antara lain :
- biasanya terjadi dari reaksi antara asam dan basa
- bersifat asam bila terbentuk dari asam kuat dan basa lemah
- bersifat basa bila terbentuk dari asam lemah dan basa kuat
- bersifat netral bila terbentuk dari asam kuat dan basa kuat atau asam lemah dan basa lemah.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Dan Kelarutan Dalam Kimia Beserta Contohnya
Jenis Larutan Garam
Garam terdiri dari 4 jenis
- Terbentuk dari asam kuat dan basa kuat ,bersifat netral contohnya NaCl,K2SO4
- Terbentuk dari asam kuat dan basa lemah ,bersifat asam, contohnya NH4Cl dan
Al2(SO4)3 - Terbentuk dari asam lemah dan basa kuat , bersifat basa, contohnya
CH3COONa,HCOOK,Na2CO3 - Terbentuk dari asam lemah dan basa lemah, sifatnya tergantung harga Ka dan Kb, contohnya (NH4)2CO3
Garam yang berasal dari Asam kuat dan Basa kuat tidak mengalami hidrolisis. pH = 7
Garam yang berasal dari Asam lemah dan Basa kuat hanya mengalami hidrolisis sebagian dalam air.

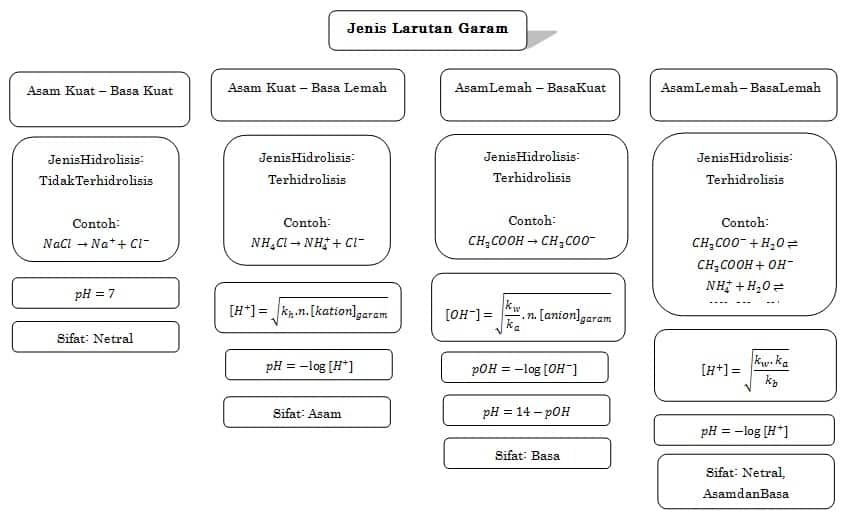
Jenis Garam Dapat Terhidrolisi, Garam terdiri dari empat jenis, yang terbagi berdasarkan komponen asam basa pembentuknya
1. Garam dari Asam Kuat dengan Basa Kuat
Asam kuat dan basa kuat bereaksi membentuk garam dan air. Kation dan anion garam berasal dari elektrolit kuat yang tidak terhidrolisis, sehingga larutan ini bersifat netral, pH larutan ini sama dengan 7.
Contoh : Garam NaCl
Di dalam air, NaCl terion sempurna membentuk ion Na+ dan Cl-
NaCl(aq) Na+(aq) + Cl-(aq)
Ion Na+ berasal dari asam kuat dan ion Cl- berasal dari basa kuat sehingga keduanya tidak bereaksi dengan air.
Na+(aq) + H2O(l) (tidak ada reaksi)
Cl-(aq) + H2O(l) (tidak ada reaksi)
Oleh karena itu, larutan tetap bersifat netral (pH=7).
2. Garam dari Asam Kuat dengan Basa Lemah
Garam yang terbentuk dari asam kuat dengan basa lemah mengalami hidrolisis sebagian (parsial) dalam air. Garam ini mengandung kation asam yang mengalami hidrolisis. Larutan garam ini bersifat asam, pH <7.
Contoh
Menghitung pH larutan garam yang bersifat Asam
Contoh larutan garam yang bersifat asam adalah NH4Cl, NH4Br, Al2(SO4)3.
Perhatikan reaksi hidrolisis berikut ini!
NH4+(aq) +H2O(l) NH4OH(aq) + H+(aq)
Reaksi hidrolisis merupakan reaksi kesetimbangan. Meskipun hanya sedikit dari garam yang mengalami reaksi hidrolisis, tapi cukup untuk mengubah pH larutan. Tetapan kesetimbangan dari reaksi hidrolisis disebut tetapan hidrolisis dan dilambangkan dengan Kh.
Kh= [NH4OH][H+] /[NH4+]
H2O diabaikan karena H2O adalah konstan. NH4OH selalu sama dengan [ H+] sehingga

3. Garam dari Asam Lemah dengan Basa Kuat
Garam yang terbentuk dari asam lemah dengan basa kuat mengalami hidrolisis parsial dalam air. Garam ini mengandung anion basa yang mengalami hidrolisis. Larutan garam ini bersifat basa (pH > 7).
Garam ini terionisasi dalam air menghasilkan ion-ion. Kation berasal dari basa kuat dan Anion berasal dari asam lemah. Contoh: CH3COONa, NaF, CH3COOK, HCOOK
Contoh : garam CH3COOBa
Menghitung pH larutan garam yang bersifat Basa
Perhatikan reaksi hidrolisis CH3COO- dari garam CH3COOBa berikut!
CH3COO- + H2O CH3COOH + OH-
Konstanta kesetimbangan reaksi hidrolisis disebut konstanta hidrolisis yang dinotasikan dengan Kh
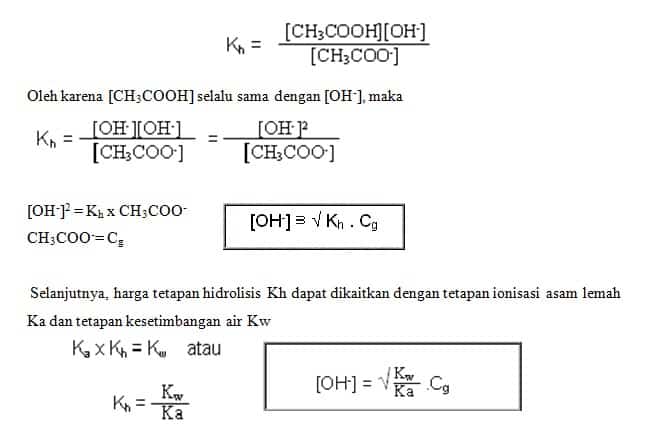
4. Garam dari Asam Lemah dengan Basa Lemah
Asam lemah dengan basa lemah dapat membentuk garam yang terhidrolisis total (sempurna) dalam air. Baik kation maupun anion dapat terhidrolisis dalam air. Larutan garam ini dapat bersifat asam, basa, maupun netral. Hal ini bergantung dari perbandingan kekuatan kation terhadap anion dalam reaksi dengan air.
Contoh
Suatu asam lemah HCN dicampur dengan basa lemah, NH 3 akan terbentuk garam NH 4 CN. HCN terionisasi sebagian dalam air membentuk H + dan CN – sedangkan NH 3 dalam air terionisasi sebagian membentuk NH4+ dan OH-. Anion basa CN – dan kation asam NH 4 + dapat terhidrolisis di dalam air.
NH 4 CN (aq) → NH 4 + (aq) + CN – (aq)
NH 4 + (aq) + H 2 O → NH 3(aq) + H 3 O (aq) +
CN – (aq) + H 2 O (e) → HCN (aq) + OH – (aq)
Garam dari Asam Lemah dengan Basa Lemah
- Sifat larutan bergantung pada kekuatan relatif asam dan basa penyusunnya (Ka dan Kb)
- Jika Ka < Kb (asam lebih lemah dari pada basa) maka anion akan terhidrolisis lebih banyak dan larutan bersifat basa.
- jika Ka > Kb (asam lebih kuat dari pada basa) maka kation akan terhidrolisis lebih banyak dalam larutan bersifat asam.
- Jika Ka = Kb (asam sama lemahnya dengan basa) maka larutan bersifat netral.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Asam, Basa, Dan Garam
Contoh Larutan Garam
Kehidupan Sehari-hari
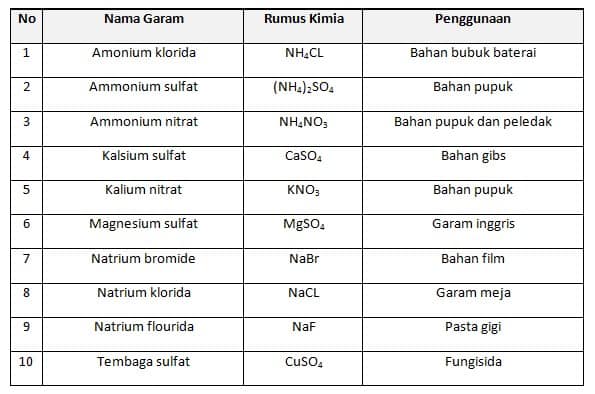
Contoh Soal 1
Berikut ini adalah beberapa contoh beserta penyelesaian soal-soal yang berkaitan dengan hidrolisis garam yang baru saja kita pelajarai bersama :
1. Berapakah pH larutan dari 100 mL larutan natrium sianida 0,01 M? (Ka HCN = 10-10)
Penyelesaian dan Jawaban:
Larutan natrium sianida terbentuk dari campuran basa kuat (NaOH) dengan asam lemah (HCN). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
NaCN(aq) → Na+(aq) + CN–(aq)
Ion yang terhidrolisis adalah ion CN–. Konsentrasi ion CN– adalah 0,01 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
- [OH-] = {(Kw /Ka)([ion yang terhidrolisis])}1/2
- [OH-] = {(10-14 / 10-10)(0,01)}1/2
- [OH-] = 10-3 M
Dengan demikian, pOH larutan adalah 3. Jadi, pH larutan garam tersebut adalah 11.
2. Berapakah pH larutan dari 200 mL larutan barium asetat 0,1 M? (Ka CH3COOH = 2.10-5)
Penyelesaian dan Jawaban:
Larutan barium asetat terbentuk dari campuran basa kuat (Ba(OH)2) dengan asam lemah (CH3COOH). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
Ba(CH3COO)2(aq) → Ba+2(aq) + 2 CH3COO–(aq)
Ion yang terhidrolisis adalah ion CH3COO–. Konsentrasi ion CH3COO– adalah 0,2 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
- [OH-] = {(Kw /Ka)([ion yang terhidrolisis])}1/2
- [OH-] = {(10-14 / 2.10-5)(0,2)}1/2
- [OH-] = 10-5 M
Dengan demikian, pOH larutan adalah 5. Jadi, pH larutan garam tersebut adalah 9.
3. Hitunglah pH larutan NH4Cl 0,42 M! (Kb NH4OH = 1,8.10-5)
Penyelesaian dan Jawaban:
Larutan amonium klorida terbentuk dari campuran basa lemah (NH4OH) dengan asam kuat (HCl). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat asam.
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Ion yang terhidrolisis adalah ion NH4+. Konsentrasi ion NH4+ adalah 0,42 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
- [H+] = {(Kw /Kb)([ion yang terhidrolisis])}1/2
- [H+] = {(10-14 / 1,8.10-5)(0,42)}1/2
- [H+] = 1,53.10-5 M
Dengan demikian, pH larutan garam tersebut adalah 4,82.
Baca Juga Artikel Yang Mungkin Berhubungan : Hidrolisis Garam : Pengertian, Macam, Dan Rumus, Beserta Contoh Soalnya Secara Lengkap
Contoh Soal 2
a.Percobaan pertama
- Timbang 5,58 gram garam dapur (NaCl)
- Masukan garam dapur ke dalam gelas kimia yang berisi air ml, kemudian diaduk
- Masukan larutan garam dapur tadi ke dalam labu ukur
- Tambahkan air sampai volume mencapai 100 ml, kemudian aduk
b. Percobaan kedua
- Masukan larutan HCl 3M + air ke dalam gelas kimia
- Lalu campurkanlarutan HCL tersebut dengan 100 ml HCL 1M
- Setelah itu ukur hingga volume mencapai 100 ml, kemudian diaduk

Kesimpulan
a. Kesimpulan pertama
Dari pengamatan dan pratikum laboratorium, kelompok kami dapat mengetahui bahwa,membuat larutan garam dapur 100 ml NaCl 1M dengan cara melarutkan garam dapur seberat 5,85 gram + air hingga mencapai volume 100 ml. Sedangkan dari hasil pratikum kimia ini kelompok kami memperoleh data konsentrasi dari Larutan NaCl adalah 1M
b. Kesimpulan kedua
Dari pengamatan dan pratikum laboratorium, kelompok kami dapat mengetahui bahwa, membuat larutan HCL 100 ml 1M dengan cara mengencerkan larutan 33,33 ml HCL 3M + air hingga mencapai volume 100 ml.
Saran
Dalam melakukan praktikum pembuatan larutan garam harus dilakukan dengan sungguh-sungguh dan teliti. Karena, apabila praktikum tidak teliti atau salah dalam menghitung massa maka akan mempengaruhi pada proses pembuatan larutan Maka dari itu, dalam praktikum ini harus hati-hati dan teliti.
Contoh Soal 3
Salah satu cara memperoleh senyawa garam adalah dengan cara mereaksikan zat asam dengan zat basa. Reaksi ini dikenal dengan reaksi penggaraman atau disebut juga reaksi netralisasi. Dalam kehidupan sehari-hari garam yang sering digunakan antara lain: garam dapur (NaCl), garam inggris (MgSO4) sebagai obat pencahar, soda kue (NaHCO3) sebagai pengembang roti, monosodium glutamat (MSG) sebagai penyedap rasa.
Sifat garam tergantung pada asam dan basa pembentuknya. Garam yang berasal dari reaksi antara asam dan basa dapat bersifat asam, basa atau netral.
Garam yang bersifat asam, memiliki pH < 7, berasal dari reaksi antara asam kuat dan basa lemah. Contoh: NH4Cl (amonium klorida / salmoniak), dan NH4NO3 (amonium nitrat).
Garam yang bersifat basa, memiliki pH > 7, berasal dari reaksi antara asam lemah dan basa kuat. Contoh: KNO2 (kalium nitrit), NaHCO3 (natrium bikarbonat / soda kue), NaCH3COO (natrium asetat), KCN (kalium sianida / potas), dan KF (kalium fosfat).
Garam yang bersifat netral, memiliki pH = 7, berasal dari asam kuat dan basa kuat.
Contoh: NaCl (natrium klorida), KI (kalium iodida), dan KNO3 (kalium nitrat).
- garam dapur, NaCl → Na+ + Cl-
- besi sulfat, Fe2(SO4)3 → 2Fe3+ + 3SO3-4
The post Pengertian Larutan Garam first appeared on GuruPendidikan.Com.
Bagaimana apakah Pengertian Larutan Garam sudah cukup untuk mengobati rasa penasaran Anda? Semoga saja demikian adanya. Terima kasih sudah meluangkan waktu mampir ke situs epicologi . blogspot . com serta membaca ulasan diatas hingga selesai. Kedepannya kami akan terus mengupdate artikel pendidikan, materi pelajaran dan informasi menarik lainnya. Untuk itu pantengin terus situs ini, kalau perlu bookmark supaya Anda mudah menemukannya lagi bila suatu saat membutuhkannya. ARTIKEL PILIHAN PEMBACA :
Posting Komentar untuk "•Pengertian Larutan Garam ~ Epicologi"