•Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh ~ Epicologi
Pada kesempatan yang indah ini kami mencoba mengetengahkan tema yang cukup banyak dicari, yaitu mengenai Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh. Kami sudah merangkum dari beberapa sumber serta dari pengalaman kami dalam penerapannya. Tak lupa kami menggunakan bahasa dan kosakata yang sederhana sehingga akan sangat mudah bagi siapapun yang membacanya. Nah, langsung disimak saja ulasannya dibawah ini.
Penjelasan Lengkap Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh
Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh : Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan diri dan masing-masing zat penyusunnya tidak dapat diedakan lagi secara fisik.
Pengertian Larutan
Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan diri dan masing-masing zat penyusunnya tidak dapat diedakan lagi secara fisik. Larutan terdiri dari zat pelarut dan terlarut. Berdasarkan daya hantar listriknya(daya ionisasinya), larutan dibagi menjadi 2 macam, yaitu larutan elektrolit dan non elektrolit.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Sistem Regulasi Pada Manusia Beserta Macam-Macamnya
Sejarah Larutan Elektrolit Dan Non Elektrolit
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini.
Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas mengahantarkan arus listrik. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit.
Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Berdasarkan percobaan yang dilakukan oleh Michael Faraday, diketahui bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan terjadi proses elektrolisis yang menghasilkan gas.
Gelembung gas ini terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi. Contoh, pada laruutan HCl terjadi reaksi elektrolisis yang menghasilkan gas hidrogen sebagai berikut.
- HCl(aq)→ H+(aq) + Cl-(aq)
- Reaksi reduksi : 2H+(aq) + 2e- → H2(g)
- Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e-
Pengertian Elektrolit
Elektrolit merupakan zat terutai atau larut di dalam bentuk ion-ion dan selanjutnya larutan menjadi konduktor elektrik, ion-ion adalah atom bermuatan elektrik. Zat elektrolit dapat berupa asam, basa, air atau juga dapat berupa senyawa kimia lainnya. Elektrolit umumnya berbentuk asam, garam atau basa. Larutan ini terbagi lagi menjadi 2, yaitu: elektrolit kuat dan elektrolit lemah.
Elektrolit Kuat
Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik yang kuat, karena zat terlarutnya didalam pelarut (umumnya air), seluruhnya berubah menjadi ion-ion (α = 1).
Baca Juga Artikel Yang Mungkin Berhubungan : Macam-Macam Jenis Dan Struktur Bagian Neuron dan Fungsinya
Yang tergolong elektrolit kuat adalah:
- Asam-asam kuat, seperti : HCl, HCl03, H2SO4, HNO3 dan lain-lain.
- Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, seperti: NaOH, KOH, Ca(OH)2, Ba(OH)2 dan lain-lain.
- Garam-garam yang mudah larut, seperti: NaCl, KI, Al2(SO4)3 dan lain-lain
Contohnya :
- Asam, contohnya asam sulfat (H2SO4), asam nitrat (HNO3), asam klorida (HCl)
- Basa, contohnya natrium hidroksida (NaOH), kalium hidroksida (KOH), barium hidroksida (Ba(OH)2)
Elektrolit Lemah
Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar: O < α < 1.
Yang tergolong elektrolit lemah:
- Asam-asam lemah, seperti : CH3COOH, HCN, H2CO3, H2S dan lain-lain
- Basa-basa lemah seperti : NH4OH, Ni(OH)2 dan lain-lain
- Garam-garam yang sukar larut, seperti : AgCl, CaCrO4, PbI2 dan lain-lain
Contohnya :
- CH3COOH, HCOOH, HF, H2CO3, dan NH4OH
Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar)
Pengertian Larutan Elektrolit
Larutan merupakan suatu antar zat penyusunan yang tidak memiliki bidang batas serta bersifat homogen di semua bagian campuran. Komponen larutan ialah pelarut dan zar terlarut. Elektrilit ialah zat yang saat dilarutkan didalam air akan mendapatkan larutan yang bisa menghasilkan arus listrik.
Baca Juga Artikel Yang Mungkin Berhubungan : Penjelasan Fungsi Batang Otak Dalam Biologi
Pengertian Non elektrolit
Nonelektrolit merupakan yang tidak bisa menghantarkan arus listrik saat dilarutkan didalam air. Semakin banyak jumlah ion, maka akan semakin kuat daya hantarnya. Dan sedangkan larutan yang tidak bisa menghantarkan arus listrik disebabkan oleh zat-zat itu tetap berwujud dalam molekul netral yang tidak bisa bermuatan.
Berdasarkan daya hantarnya larutan elektrolit terbagi menjadi dua, yaitu elektrolit yang kuat dengan daya hantar yang besar. Misalnya dalam larutan asam kuat, basa kuat serta garam. yang kedua elektrolit lemah, yakni sebuah larutan dengan daya hantar yang lemah.
Tergolong ke dalam jenis ini misalnya:
- Larutan urea (CO(NH2)2)
- Larutan sukrosa
- Larutan gula (C12H22o11)
- Larutan glukosa (C6H12O6)
- Larutan alkohol (C2H5OH)
Senyawa Pembentuk Larutan Elektrolit
Senyawa yang didalam larutannya bisa menghantar arus listrik berupa senyawa ion serta senyawa kovalen polar, sebab senyawa-senyawa tersebut bisa terionisasi waktu dilarutkan didalan air.
Senyawa ion
Senyawa ion mempunyai susunan dari berberapa ion yang memiliki bentuk padat serta kering. Ion-ion penyusun senyawa ion dalam pelarutnya akan bergerak bebas sehingga larutan ion bisa menghantarkan arus listrik. Senyawa ion yang bernntuk kristal, ion-ion-nya tidak bisa bergerak bebas sehingga tidak bisa menghantarkan arus listrik. Sebagai contoh NaCl, KCl, NaOH dan KOH.
Senyawa Kovalen Polar
Senyawa kovalen polar jika dilarutkan didalam air, maka akan terurai berubah menjadi ion-ion. Hal ini dikarenakan oleh ikatan kovalen pada senyawa tersebut mudah putus didalam pelarut ait serta menghasilkan ion-ion. Sabagai contoh asam klorida (HCl), Amonia (NH3).
Baca Juga Artikel Yang Mungkin Berhubungan : Penjelasan Fungsi Medula Oblongata Dalam Biologi
Cara Larutan Elektrolit Menghantarkan Arus listrik
Larutan elektrolit ada pada ion-ion yang memiliki perbedaan muatan serta bergerak bebas. Jika arus listrik dihubungkan, kation bergerak menuju kotade serta anion bergerak menuju anode sehingga arus listrik dapat mengalir dalam sebuah sistem.
Contoh non elektrolit
Dibawah ini ialah termasuk yang merupakan larutan non elektrolit yakni:
- Larutan sukrosa
- Larutan alkohol
- Larutan glukosa
- Larutan urea
Proses Pelarutan Secara Umum
Larutan merupakan fase yang setiap hari ada disekitar kita. Suatu sistem homogen yang mengandung dua atau lebih zat yang masing-masing komponennya tidak bisa dibedakan secara fisik disebut larutan, sedangkan suatu sistem yang heterogen disebut campuran.
Biasanya istilah larutan dianggap sebagai cairan yang mengandung zat terlarut, misalnya padatan atau gas dengan kata lain larutan tidak hanya terbatas pada cairan saja.
Komponen dari larutan terdiri dari dua jenis, pelarut dan zat terlarut, yang dapat dipertukarkan tergantung jumlahnya. Pelarut merupakan komponen yang utama yang terdapat dalam jumlah yang banyak, sedangkan komponen minornya merupakan zat terlarut.
Larutan terbentuk melalui pencampuran dua atau lebih zat murni yang molekulnya berinteraksi langsung dalam keadaan tercampur. Semua gas bersifat dapat bercampur dengan sesamanya, karena itu campuran gas adalah larutan. Proses pelarutan dapat diilustrasikan seperti Gambar di atas.
Jenis – Jenis Larutan
- Gas dalam gas – seluruh campuran gas
- Gas dalam cairan – oksigen dalam air
- Cairan dalam cairan – alkohol dalam air
- Padatan dalam cairan – gula dalam air
- Gas dalam padatan – hidrogen dalam paladium
- Cairan dalam padatan – Hg dalam perak
- Padatan dalam padatan – alloys
Baca Juga Artikel Yang Mungkin Berhubungan : Perbedaan Amfibi Dan Reptil Dalam Biologi
The post Elektrolit Dan Non Elektrolit - Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh first appeared on GuruPendidikan.Com.
Bagaimana apakah Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh sudah cukup untuk mengobati rasa penasaran Anda? Semoga saja demikian adanya. Terima kasih sudah meluangkan waktu mampir ke situs epicologi . blogspot . com serta membaca ulasan diatas hingga selesai. Kedepannya kami akan terus mengupdate artikel pendidikan, materi pelajaran dan informasi menarik lainnya. Untuk itu pantengin terus situs ini, kalau perlu bookmark supaya Anda mudah menemukannya lagi bila suatu saat membutuhkannya. ARTIKEL PILIHAN PEMBACA :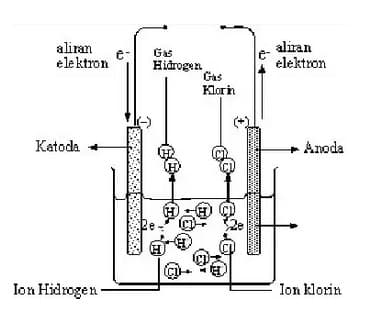

Posting Komentar untuk "•Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh ~ Epicologi"